罕見疾病 2018-08-21
罕見疾病
罕見疾病是指僅在極少數人身上發生的病症,因為人數極少所以也被稱為孤兒病。目前全世界已發現超過7000種罕見疾病。
八成左右的罕見疾病為基因遺傳,即使疾病症狀不是一出生就能觀察到,也會伴隨患者終身。罕見疾病有一半以上的病患為小孩。75%的罕見疾病患者在幼兒時期就會發病,而大約有30%罕見疾病的患者會在5歲之前死亡。目前只有約5%的罕見疾病有成功研發經美國FDA認可之治療藥物。
罕見疾病的病患常常因無法及時獲得正確的診斷,加上對該疾病資訊不足,導致在發病前無法獲得良好的照護及治療。
各國對於罕見疾病定義不盡相同,根據美國「孤兒藥品法」(Orphan Drug Act)之界定,凡是美國境內罹病人數少於二十萬人之疾病,即屬罕見疾病。估計美國境內所有罕見疾病病患總數約3000萬人。
歐洲依據Regulation (EC) No 141/2000定義疾病罹患率低於萬分之5為罕見疾病,估計歐洲所有罕見疾病病患總數約3000萬人
而台灣依照《罕見疾病防治及藥物法》規定,罹患率低於萬分之1為罕見疾病。截至107年1月,政府已公告接獲通報確診罕見疾病病人1萬4,500餘人;但依歐美的比率推論,台灣的罕病患者可能達一百五十萬人,故可能有高達99%的患者未被診斷出或遭到誤診。
罕見疾病新藥開發的難題
1.罕見疾病的種類甚多,但因為個別疾病的病人數很少,學術與醫界的研究量亦小,導致疾病的致病機轉不明,難有明確或已驗證的藥物作用標的。
2.罕見疾病人數非常少,臨床試驗收案困難,試驗設計的難度也高。
3.罕見疾病確診不易,須仰賴醫師豐富的臨床經驗及精密的檢查,甚或基因檢測,方能確切診斷。
孤兒藥及孤兒藥研發現況
孤兒藥(Orphan Drug)又稱罕用藥,是用來治癒(cure)或是治療(treat)罕見疾病的藥物。
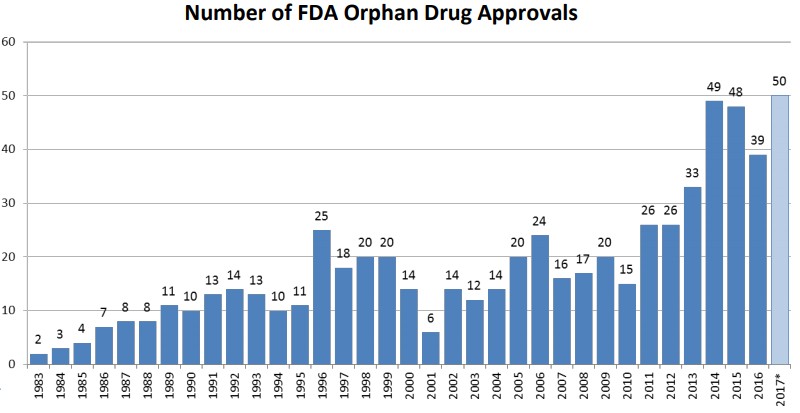
自美國罕見疾病組織(NORD)成立後,成功地使美國國會在1983年初通過了孤兒藥品法(Orphan Drug Act)。雖然孤兒藥數量有逐年增加的趨勢,但截至目前,仍只有5%的罕見疾病有藥物治療。為鼓勵各藥廠投入資源研發罕見疾病藥物,各國政府機關訂定相關法規對新藥研發提出優惠如申請查驗費用減免、稅額扣抵及市場獨佔權...等。
美國FDA對於新藥開發的研究經費及委託進行臨床試驗、試驗費用補助,及能享有20%的稅額扣抵之外,還能自藥品批准日後七年內擁有市場獨佔權。
歐洲EMA則是協助臨床試驗設計、研究補助、上市申請費用及維持費用減免以及有十年的市場獨佔權。
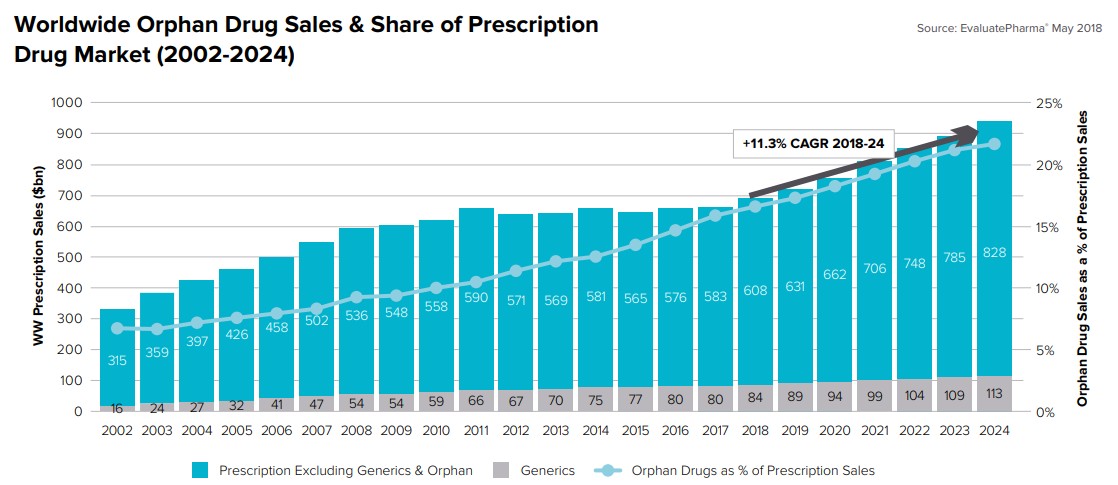
全球孤兒藥的銷售金額在2017年為583億美元,Evalutepharma預測在2024年將達到2620億美元。2018年至2024年間孤兒藥的複合年增長率預測為11.3%,約為非孤兒市場的兩倍。

